【生物化学】1.氨基酸的发现和结构及分类
蛋白质是生命功能里最重要的物质之一。组成蛋白质的基本单位是氨基酸。要学习生物化学,就从氨基酸开始吧。
第一个被发现的氨基酸是在1806年,由法国化学家在芦笋里面分离出了天冬氨酸,Auguste Arthur Plisson和Étienne Ossian Henry通过水解1806年从芦笋汁中分离出的芦笋胺(asparagine),首次发现了天冬氨酸。他们最初的方法是用氢氧化铅,但现在更常用其他各种酸或碱来代替。而后陆续有几个氨基酸被单独发现,最后确立氨基酸的命名则是在1900年左右通过化学家在实验室水解不同的蛋白,得到了很多种不同的氨基酸,即有一个氨基一个羧基和一个侧链的结构的物质。1820年在蛋白质的水解产物中发现了结构最简单的甘氨酸,到1940年已发现自然界中有20种左右的氨基酸。
世界上最早从事氨基酸工业化生产的是日本味之素公司。20世纪40年代初在实验室中偶然发现:在海带浸泡液中可提取出一种白色针状结晶物。该物质具有强烈鲜味,分析结果表明它是谷氨酸的一种钠盐。菊地重雄最后终于找到一种工业化生产味之素的新途径即利用小麦粉加工淀粉后剩下的“面筋”为原料,首先用盐酸将其水解得到谷氨酸,然后加入纯碱中和即可得到食品级的谷氨酸钠。
此后,科学家利用蛋白质水解法可将羽毛、人发、猪血等原料水解成为氨基酸,但这些氨基酸多为“DL混合型氨基酸”其拆分十分困难。在60年代确立的工业微生物发酵法使氨基酸工业开始起飞。此后许多种常用氨基酸品种均可利用微生物发酵法生产,从而使其产量大增,成本大为下降。
根据氨基酸发现的历史,我们发现水解作用是研究蛋白质组分的最重要的方法之一。
1.蛋白质的水解
在水解的过程中,蛋白质不一定能直接完全分解为氨基酸混合物。一个现实的过程中,蛋白质会逐渐被降解为相对分子质量越来越小的肽碎片。如果最终产物里仍有肽碎片,蛋白质就是部分水解。如果最后只剩下了各种各样的氨基酸,那蛋白质就是完全水解。
我们可以用这样一个化学方程式来描述水解的过程:H-[-NH2CHRCO-]n-OH + nH2O= nNH2CHRCOOH。一般有三种常用的水解方法:
1. 酸法水解:通常以5-10倍的20%HCl煮沸回流16h-20h,或加压于120摄氏度水解12h,可将蛋白质水解成氨基酸。优点:水解彻底,水解的最终产物是L-氨基酸,没有旋光异构体的产生。缺点:营养价值较高的色氨酸几乎全部被破环,而与含醛基的化合物(如糖)作用生成一种黑色物质,称为腐黑质,因此水解液呈黑色。此外,含羟基的丝氨酸、苏氨酸、洛氨酸也有部分被破坏。此法常用于蛋白质的分析与制备。
2. 碱法水解:可用6摩尔每升NaOH或4摩尔每升氢氧化钡煮沸6小时即可完全水解得到氨基酸。优点:色氨酸不被破坏,水解液清亮。缺点:水解产生的氨基酸发生旋光异构作用,产物有D-型和L-型两类氨基酸。D-型氨基酸不能被人体分解利用,因而营养价值减半;此外,丝氨酸、苏氨酸、赖氨酸、胱氨酸等大部分被破坏,碱水解还会引起精氨酸脱氨作用,生成鸟氨酸和尿素。因此碱水解法一般很少使用。
3. 蛋白酶法水解:优点:条件温和,常温(36-60摄氏度)\常压和PH值在2-8时,氨基酸完全不被破坏,不发生旋光异构现象。缺点:水解不彻底,中间产物较多。根据水解的程度分(蛋白质–膘–胨–多肽–二肽–氨基酸)蛋白质煮沸时可凝固,而膘、胨、肽均不能:蛋白质和膘可被饱和的硫酸铵和硫酸锌沉淀,而胨以下的产物均不能;胨可被磷钨酸等复盐沉淀,而肽类及氨基酸均不能,借此可将产物分开。常用的蛋白酶包括:胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶等。
水解出来的产物是各种各样的氨基酸,我们现在来研究他们都是什么样子的吧:
2.α -氨基酸的一般结构
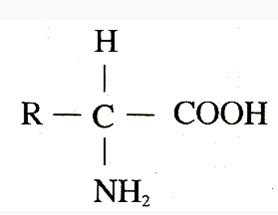
氨基酸的结构是由一个氨基、一个羧基、一个氢和一个R基连在同一个中心C原子上组成。这样分子式就为C2H4O2R。与羧基相邻的中心碳原子(也就是α -碳原子)上都有一个氨基,所以称为α -氨基酸。

生物选用a−氨基酸作为蛋白质构件分子是因为两个氨基酸的a−碳原子上的氨基与羧基形成酰胺键,让肽链骨架上的原子靠的更近,有利于彼此间相互作用,有利于蛋白质空间结构维持稳定。
其次,蛋白质中发现的氨基酸都是L型的,但是这不意味着D型氨基酸没有活性,其中猜测选用L型氨基酸可能是进化的偶然性。有实验表明,D型氨基酸构成的多肽也可以有活性,例如人工合成的全D型氨基酸构成的HIV外壳上的酸性蛋白酶。
这篇文章关于这一点讲得特别好: 为什么蛋白质中都是 L 型氨基酸,且是 α 氨基酸? – 知乎 (zhihu.com)
3.氨基酸的种类
我们可能会猜测:蛋白质分子那么复杂,组成蛋白质的氨基酸的种类应该多得数不清吧?事实上,在各种生命体内发现的氨基酸有300+种,但是绝大多数都是不参加蛋白质合成的。参与蛋白质合成的氨基酸叫做蛋白质氨基酸。其中包括了20种(或22种)基本氨基酸和很少一些不常见的氨基酸。他们分别是:
| 缩写 | 中文译名 | 支链 | 分子量 | 等电点 | 羧基解离常数 | 氨基解离常数 | Pkr(R) | R基 | |
|---|---|---|---|---|---|---|---|---|---|
| Gly | G | 甘氨酸 | 亲水性 | 75.07 | 5.97 | 2.34 | 9.60 | -H | |
| Ala | A | 丙氨酸 | 疏水性 | 89.09 | 6.00 | 2.35 | 9.87 | -CH₃ | |
| Val | V | 缬氨酸 | 疏水性 | 117.15 | 5.96 | 2.29 | 9.72 | -CH-(CH₃)₂ | |
| Leu | L | 亮氨酸 | 疏水性 | 131.17 | 5.98 | 2.33 | 9.74 | -CH₂-CH(CH₃)₂ | |
| Ile | I | 异亮氨酸 | 疏水性 | 131.17 | 6.02 | 2.32 | 9.76 | -CH(CH₃)-CH₂-CH₃ | |
| Phe | F | 苯丙氨酸 | 疏水性 | 165.19 | 5.48 | 2.58 | 9.24 | -CH₂-C₆H₅ | |
| Trp | W | 色氨酸 | 疏水性 | 204.23 | 5.89 | 2.43 | 9.44 | -CH₂-C₈NH₆ | |
| Tyr | Y | 酪氨酸 | 亲水性 | 181.19 | 5.66 | 2.20 | 9.2110.07ᶜ | 10.46 | -CH₂-C₆H₄-OH |
| Asp | D | 天冬氨酸 | 酸性 | 133.10 | 2.77 | 1.883.65ᵇ | 9.60 | 3.90 | -CH₂-COOH |
| Asn | N | 天冬酰胺 | 亲水性 | 132.12 | 5.41 | 2.02 | 8.80 | -CH₂-CONH₂ | |
| Glu | E | 谷氨酸 | 酸性 | 147.13 | 3.22 | 2.134.32ᵇ | 9.60 | 4.07 | -(CH₂)₂-COOH |
| Lys | K | 赖氨酸 | 碱性 | 146.19 | 9.74 | 2.18 | 8.9510.53ᶜ | 10.54 | -(CH₂)₄-NH₂ |
| Gln | Q | 谷氨酰胺 | 亲水性 | 146.15 | 5.65 | 2.17 | 9.13 | -(CH₂)₂-CONH₂ | |
| Met | M | 甲硫氨酸 | 疏水性 | 149.21 | 5.74 | 2.13 | 9.28 | -(CH₂)2-S-CH₃ | |
| Ser | S | 丝氨酸 | 亲水性 | 105.09 | 5.68 | 2.19 | 9.44 | -CH₂-OH | |
| Thr | T | 苏氨酸 | 亲水性 | 119.12 | 5.60 | 2.09 | 9.10 | -CH(CH₃)-OH | |
| Cys | C | 半胱氨酸 | 亲水性 | 121.16 | 5.07 | 1.86 | 8.35 | 8.37 | -CH₂-SH |
| Pro | P | 脯氨酸 | 疏水性 | 115.13 | 6.30 | 1.95 | 10.64 | -C₃H₆ | |
| His | H | 组氨酸 | 碱性 | 155.16 | 7.59 | 1.81 | 6.059.15ᶜ | 6.04 | -CH2-C3H3N2 |
| Arg | R | 精氨酸 | 碱性 | 174.20 | 10.76 | 1.82 | 8.9913.20ᶜ | 12.48 | -(CH2)3-NHC(NH)NH2 |
实际上,硒代半胱氨酸(存在于少数一些酶中,如谷胱甘肽过氧化酶、甲状腺素5′-脱碘酶、硫氧还蛋白还原酶、甲酸脱氢酶、甘氨酸还原酶和一些氢化酶等。硒半胱氨酸的结构和半胱氨酸类似,只是其中的硫原子被硒取代,包含硒半胱氨酸残基的蛋白都称为硒蛋白。实际上是丝氨酸的衍生)和吡咯赖氨酸(甲烷菌的甲胺甲基转移酶)也是基本氨基酸。
研究基本氨基酸的性质是一个非常有意义的事情。比如近期大火的Alphafold的基石就是各种氨基酸的性质。两个最重要的性质是酸碱性和极性。所以一般的分类方法会把氨基酸分为五种:非极性类(非脂肪族氨基酸、芳香族氨基酸)和极性氨基酸(极性不带电荷的氨基酸、酸性氨基酸、碱性氨基酸)。
非脂肪族氨基酸:包括甘氨酸(唯一不含手性碳原子的氨基酸,没有旋光性,最简单的氨基酸)、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸(两个含硫的氨基酸之一,侧链上的非极性的硫醚基是代谢中的甲基供体)、脯氨酸(必须氨基酸中唯一的亚氨基酸,没有自由的α -氨基。脯氨酸使其所在的多肽区域结构柔性降低)。甘氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸在蛋白质分子中倾向于成串聚集,借疏水作用稳定蛋白质的结构。
芳香族氨基酸:包括苯丙氨酸(苯丙酮尿症)、酪氨酸(形成氢键,是一些酶的功能基)、色氨酸(烟酸的前体,维生素PP)。这三者的一个非常重要的性质是在280nm处有紫外光吸收峰,这是凯氏定氮法等方法的基本原理。其中色氨酸和酪氨酸的吸收峰特别显著。
极性不带电荷的氨基酸:包括丝氨酸、苏氨酸、半胱氨酸(巯基,含硫,形成二硫桥)、天冬酰胺、谷氨酰胺。他们能形成氢键。
碱性氨基酸:赖氨酸、精氨酸(胍基)、组氨酸(唯一的等电点在中性附近的氨基酸。质子供、受体,促进酶促反应)。
酸性氨基酸:天冬氨酸、谷氨酰胺
4.其它氨基酸
除了二十种基本氨基酸,某些蛋白质中还存在一些不常见的氨基酸。另外,还有一些氨基酸不参与蛋白质组成,但是有各种各样奇奇怪怪的生物学功能。
非蛋白质氨基酸主要是一些代谢中间物,最典型的就是瓜氨酸和鸟氨酸,这是尿素循环里重要的中间产物。在一碳代谢中过程产物有肌氨酸。谷氨酸脱氨作用可以产生γ-氨基丁酸,这是一种神经递质。另外D-环丝氨酸是一种常用的抗生素。
蛋白质中也有一些耳熟能详的不常见氨基酸。比如4-羟脯氨酸(来自脯氨酸)和5-羟赖氨酸(来自赖氨酸)是胶原蛋白的组分。酪氨酸的衍生物甲状腺素是甲状球蛋白的组分。